QUE ES LA CORROSIÓN.
La corrosión es un proceso natural que implica el deterioro de los componentes metálicos. Se puede definir como “la destrucción de las propiedades de un elemento (generalmente un metal) debido a una reacción con su entorno”. En última instancia, esto causa daños potencialmente graves a partes y piezas que componen un edificio o aplicación y puede resultar muy costoso de reparar.
CÓMO OCURRE LA CORROSIÓN
La corrosión es una reacción electroquímica que se presenta en varias formas, como la química y la atmosférica, esta última, es la forma más común. Cuando las sustancias ácidas (incluida el agua) entran en contacto con metales, como el hierro y / o el acero, comienza a formarse óxido. El óxido es el resultado de la corrosión del acero después de que las partículas de hierro (Fe) hayan sido expuestas al oxígeno y la humedad (por ejemplo, humedad, vapor, inmersión). Cuando el acero se expone al agua, las partículas de hierro se pierden en los electrolitos ácidos del agua. Las partículas de hierro luego se oxidan, lo que resulta en la formación de Fe⁺⁺. Cuando se forma Fe⁺⁺, se liberan dos electrones y fluyen a través del acero a otra área del acero conocida como área catódica.
El oxígeno hace que estos electrones se eleven y formen iones hidroxilo (OH). Los iones hidroxilo reaccionan con el Fe⁺⁺ para formar óxido de hierro hidratado (FeOH), más conocido como óxido. Donde estaban las partículas de hierro afectadas, ahora se ha convertido en una fuente de corrosión, y donde están ahora, se llama producto de corrosión (óxido).
La corrosión puede ocurrir en cualquier caso, dependiendo del entorno en el que se encuentre el metal. Sin embargo, dado que la corrosión atmosférica está tan extendida, se recomienda tomar medidas de precaución eficaces cuando se trata de prevenir la corrosión.
CORROSIÓN GALVANICA.
La corrosión galvánica (también llamada “corrosión de metales distintos” o erróneamente “electrólisis”) se refiere al daño por corrosión inducido cuando dos materiales diferentes se acoplan en un electrolito corrosivo. Ocurre cuando dos (o más) metales diferentes entran en contacto eléctrico bajo el agua. Cuando se forma un par galvánico, uno de los metales del par se convierte en el ánodo y se corroe más rápido de lo que lo haría por sí solo, mientras que el otro se convierte en el cátodo y se corroe más lentamente de lo que lo haría solo.
Cualquiera (o ambos) metales de la pareja pueden o no corroerse por sí mismos .. Sin embargo, cuando se hace contacto con un metal diferente, las tasas de auto corrosión cambiarán: la corrosión del ánodo se acelerará. La corrosión del cátodo se desacelerará o incluso se detendrá. El acoplamiento galvánico es la base de muchas técnicas de control de la corrosión.
La fuerza impulsora de la corrosión es una diferencia de potencial entre los diferentes materiales. La fuerza impulsora bimetálica fue descubierta a fines del siglo XVIII por Luigi Galvani en una serie de experimentos con los músculos y nervios expuestos de una rana que se contraía cuando se conectaba a un conductor bimetálico. El principio fue aplicado más tarde en una aplicación práctica por Alessandro Volta quien construyó, en 1800, la primera celda eléctrica o batería: una serie de discos de metal de dos tipos, separados por discos de cartón empapados con soluciones ácidas o salinas. Esta es la base de todas las baterías modernas de celda húmeda y fue un descubrimiento científico tremendamente importante, porque fue el primer método encontrado para la generación de una corriente eléctrica sostenida.
El principio también fue diseñado para la protección útil de estructuras metálicas por Sir Humphry Davy y Michael Faraday a principios del siglo XIX. La corrosión sacrificatoria de un metal como el zinc, el magnesio o el aluminio es un método generalizado para proteger catódicamente estructuras metálicas.
En un par bimetálico, el material menos noble se convertirá en el ánodo de esta celda de corrosión y tenderá a corroerse a un ritmo acelerado, en comparación con la condición desacoplada. El material más noble actuará como cátodo en la celda de corrosión. La corrosión galvánica puede ser una de las formas más comunes de corrosión, así como una de las más destructivas.
En la siguiente tabla podemos apreciar los potenciales de los metales. si combinamos metales que estén más distantes en la tabla, es decir, mientras más electropositivo, más capacidad de convertirse en cátodo en desmedro de los que tienen menos potencial (ánodo).
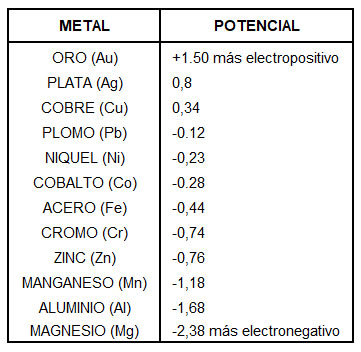
La nobleza relativa de un material se puede predecir midiendo su potencial de corrosión. La conocida serie galvánica enumera la relativa nobleza de ciertos materiales en el agua de mar. Una relación pequeña del área ánodo/cátodo es altamente indeseable. En este caso, la corriente galvánica se concentra en una pequeña área anódica. En estas condiciones, tiende a producirse una rápida pérdida de espesor del ánodo en disolución. Los problemas de corrosión galvánica deben resolverse con un diseño para evitar estos problemas.
COMO PREVENIR LA CORROSIÓN GALVANICA EN UNA ESTRUCTURA.
Cuando se utilizan materiales que deben estar en contacto, estos deben ser la misma naturaleza o que estén lo suficiente próximos entre ellos en la serie galvánica (Ver tabla).






